类器官的发展历史
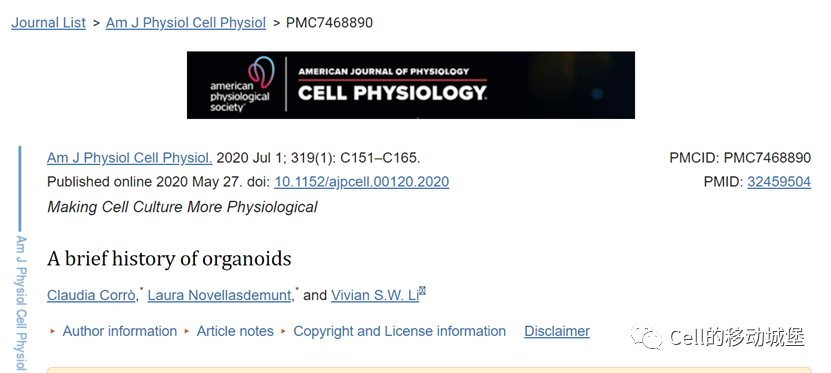
类器官的发展时间轴
早在1907年,Henry Van Peters Wilson描述了体外再生的第一次尝试,他证明了游离的海绵细胞可以自我组织再生一个完整的生物(159)。几十年后,几个小组进行了分离-再聚合实验,从分离的两栖动物前肾(46a)和鸡胚(158)中生成不同类型的器官。1964年,Malcolm Steinberg提出了微分粘附假说,提出细胞的分选和重排可以用微分表面粘附介导的热力学来解释(135)。1981年,当多能干细胞(PSCs)首次从小鼠胚胎中分离并建立时,干细胞研究开始蓬勃发展(34,84)。但是直到1998年,科学家们才能够从人类囊胚中分离和培养胚胎干细胞(145)。后来,通过对小鼠和人成纤维细胞的重新编程,建立了诱导多能干细胞,这对干细胞和类器官的研究带来了重大的影响。
1987年,科学家们开始通过模拟体内微环境来改善细胞培养条件。Li等人(75)证明,当在EHS ECM提取物上生长时,乳腺上皮细胞可以形成3D导管和管腔,与二维(2D)培养相比,它们似乎能够合成和分泌乳蛋白。同样,肺泡II型上皮细胞能够在ECM基质存在的情况下维持其分化(128),这突出了细胞-基质相互作用在组织维持和分化中的重要性。当Eiraku等人(31)能够使用3D聚集培养法从esc中生成大脑皮层组织时,类器官研究开始从2D向3D转变。2009年,Sato等人(119)的一项里程碑式的研究表明,成人肠干细胞(这种细胞富含亮氨酸重复序列的G蛋白偶联受体5 (Lgr5))可以在基质细胞中形成三维类肠器官,在缺乏间叶细胞利基的情况下,自组织并分化为窝-绒毛结构。这是关于建立从单个ASC衍生出的3D类器官培养的第一份报告,为使用ASC或PSCs在其他系统中包括中胚层(如胃、肝、胰腺、肺和肾)和神经外胚层(大脑和视网膜)等许多后续的类器官培养工作奠定了基础(图1)。
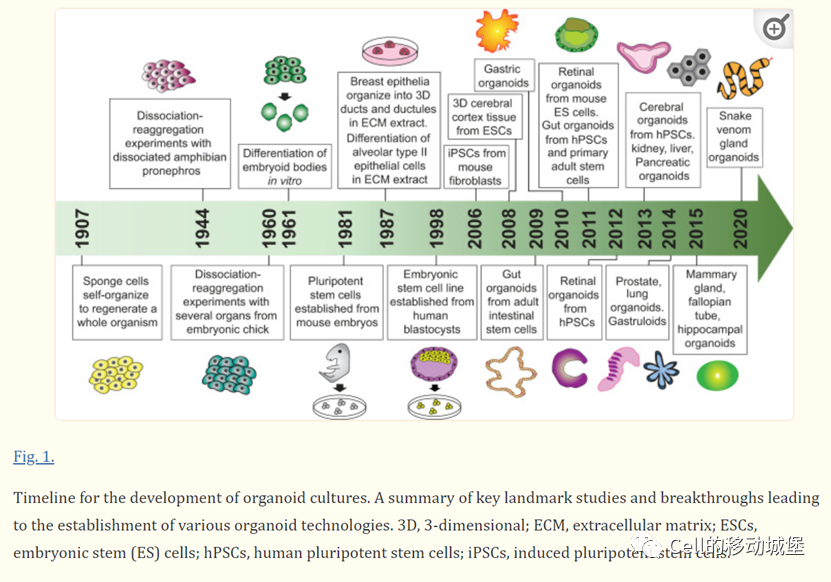
类器官的应用
类器官正在成为许多生物医学研究的主流工具之一。类器官具有广泛的组织类型、长期的扩展能力和生理上的3D结构,这些特点使其成为许多生物和临床应用研究的新技术。值得注意的是,类器官已被广泛应用于疾病建模、精准医学、毒理学研究和再生医学(图2)。
3D类器官的优势和局限
primary patient-derived organoids (PDOs)
Patient-derived xenografts (PDXs)
genetically engineered mouse models (GEMMs)
一旦培养条件得到优化,产生PDOs相对容易,并且可以从有限的原始组织材料,如针活检、尿液(120)或支气管灌洗材料(114)中提取。相反,从原代组织中获得细胞系往往效率低下,二维培养也会带来大量的遗传变化。与永生细胞系相比,在再现原代组织的三维结构、异质性和细胞功能方面,类器官表现更优秀,因此,在模拟人类疾病和预测药物反应方面更具有生理学意义。其他模型如PDXs和GEMMs可以更好地在体内再现人类疾病,但它们非常昂贵、耗费人工和时间,因此,它们不适合用于高通量筛查。
虽然类器官技术弥补了细胞系和体内模型之间的差距,但目前的系统仍有局限性。尽管PDOs是异质性的,但大多数PDOs在培养中缺乏周围基质细胞,不能重建肿瘤微环境(TME)。TME不仅包括周围的成纤维细胞和内皮细胞,还包括免疫细胞和ECM(细胞外基质)。PDOs缺乏TME可能会影响其预测临床结果的应用。
大多数类器官在饱和生长因子的培养基中培养。与2D细胞系培养相比,基质胶的存在可能影响功能/生化测定,并使细胞收集和传代复杂化。此外,在类器官周围富集的生长因子可能会破坏组织的自然形态梯度。针对类脑器官培养优化的旋转生物反应器可以解决其中的一些问题。然而,Bhaduri等人(12)最近研究表明,皮质类器官异位激活细胞应激途径,损害细胞类型的特异性,因此不能再现不同的细胞亚型或祖细胞成熟。这些数据表明,这些类脑器官的保真度需要进一步评估。
除了上述限制之外,在大规模推广到临床之前,仍有一些实用性问题需要解决。例如,PDO生产的高试剂成本使患者或卫生保健系统不太可能负担得起。值得注意的是,由于复杂的3D培养系统,扩大PDOs不像在细胞系中那么容易。最后,制定一致的和标准化的药物筛选策略对于可靠地预测患者在临床中的治疗效果至关重要。
转自公众号:Cell的移动城堡

 在线咨询
在线咨询 